Фосфат кальция карбонат кальция. Описание пищевой добавки
Фосфат кальция карбонат кальция. Описание пищевой добавки
Ортофосфат кальция (пищевая добавка E-341 ) — представляет собой белый аморфный порошок, малорастворимый в воде, но растворяющийся в кислотах. В отличие от многих химических веществ растворимость фосфатов падает с увеличением температуры. Из всех гидроксиапатитов (соединений фосфата кальция), ортофосфат кальция наиболее устойчив к воздействию внеклеточных жидкостей организма и выполняет важную роль в ряде физиологических процессов. Природные источники: Фосфаты кальция содержатся в молоке. В организме человека кальций существует в основном в виде фосфатов кальция. Кости человека на семьдесят процентов состоят из фосфатов кальция. Зубная эмаль тоже большей частью состоит из гидроксиапатитов.
Подвиды ортофосфатов кальция, используемых в пищевой промышленности:
E-341 (I) monocalcium phosphate - ортофосфат кальция однозамещенный с химической формулой: Ca
Фосфат кальция вред. Фосфат кальция (Е341)
Фосфат кальция – вещество, которое имеет кодовый номер Е341. Данная добавка является консервантом, обладающим свойствами антиоксиданта и применяется в качестве разрыхлителя в пищевой промышленности.
Качества, которыми обладает данная добавка сделали ее достаточно популярной во многих областях промышленности. Она стала известной не только как разрыхлитель, но и как эмульгатор и уплотнитель. Также продукт применяется как стабилизатор, регулятор кислотности и фиксатор.
Фосфат кальция – это синтетическое неорганическое вещество. Исходное сырье для данного продукта – минералы (апатит, фосфорит, гидроксилапатит). Для получения готового вещества, сырье проходит гидротермический обжиг, после чего к нему добавляется полугидратная фосфорная кислота. Готовая добавка имеет вид аморфного белого порошка, которая активно растворяется в различных кислотах, чего нельзя сказать о простой воде .
Добавка Е341 имеет 3 подвида. Каждый из них нашел применение в различных отраслях жизнедеятельности человека. Антиоксидант обладает устойчивостью к воздействию внеклеточной жидкости. Если искать аналог природного происхождения, то с уверенностью можно сказать, что определенное количество фосфата кальция есть содержится в молоке коровы. Также около 70 процентов этой соли находится в любой костной ткани.
В промышленности фосфат кальция добывают при соединении ортофосфорной кислоты, известкового молока и оксида кальция. Стоит отметить, что растворимость фосфата кальция снижается при увеличении температуры.
Применение фосфата кальция
Пищевую добавку Е341 используют в пищевой промышленности в качестве стабилизатора вкуса, регулятора кислотности, разрыхлителя и фиксатора. Также фосфат кальция добавляют, как эмульгирующую соль при производстве плавленого сыра . Нередко его применяют при производстве сухого молока , сливок , сгущенного молока , различных фруктовых и овощных консервов.
Наиболее популярно его применение при изготовлении хлебобулочных изделий, специальных напитков для спортсменов, фаршей, сухих чаев , завтраков, различных полуфабрикатов и биологически активных добавок .
Кроме пищевой промышленности, добавка Е341 является компонентом в зубных пастах и порошках, ее используют при производстве керамических изделий, стекол и мягких абразивов. Кроме того, достаточно распространены фосфаты кальция при изготовлении кормов для животных. Также не обходятся без этого вещества и производители различных удобрений.
Полезные свойства и вред
Исследования и тестирование добавки Е341 ведутся уже примерно 50 лет. Доказательств того, что добавка вредна для организма человека на сегодняшний день нет, но мнение о вреде фосфата кальция все же имеет свое место.
Некоторые ученые уверены в том, что добавка Е341 обладает канцерогенным воздействием и способствует появлению в организме излишков холестерина .
Это может вызвать заболевания и нарушения работы желудочно-кишечного тракта. Несмотря на предполагаемый вред, добавку Е341 принято считать одним из главных компонентов для нормальной работы организма человека. Данное вещество принимает непосредственное участие во многих важных физиологических процессах.
Стоит помнить, что именно из фосфата кальция на 70 процентов состоят человеческие кости. Кроме того, зубная эмаль также в основном состоит из этого вещества.
Фосфат кальция уравнение реакции. Ca3(PO4)2 + H2SO4 = ? уравнение реакции
Составьте химическое уравнение по схеме Ca3(PO4)2 + H2SO4 = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Дайте краткую характеристику физических и химических свойств продукта реакции, содержащего в своем составе фосфор; приведите способы его получения.
1 ответ
0
В результате взаимодействия фосфата кальция с серной кислотой (Ca3(PO4)2 + H2SO4 = ?) можно получить различные продукты. Если реакцию проводить в температурном диапазоне, то образуются фосфорная кислота и сульфат кальция (промышленный способ получения фосфорной кислоты). В случае действия на фосфат кальция концентрированной кислоты образуются дигидрофосфат и сульфат кальция (получение простого суперфсфата). Молекулярные уравнения реакций имеют вид:
Ортофосфорная кислота при обычных условиях представляет собой белые, гигроскопичные кристаллы. Плавится без разложения (). В жидком состоянии склонна к переохлаждению, при умеренном нагревании разлагается. Хорошо растворяется в воде. Является слабой кислотой.
Фосфорная кислота нейтрализуется щелочами, гидратом аммиака, реагирует с типичными металлами. Образует пероксо-, изополи- и гетерополисоединения.
Фосфат кальция таблетки. Ортофосфат кальция
| Ортофосфат кальция | |
|---|---|
| ( {{{картинка}}}) 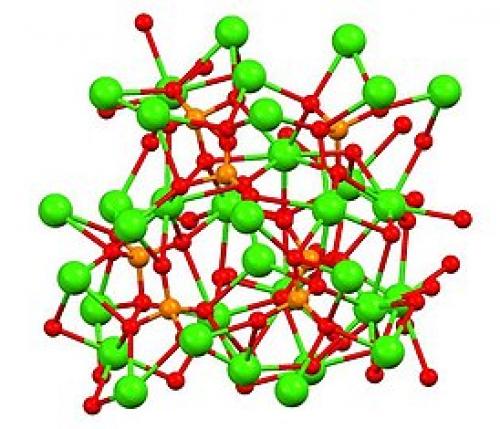 ( ({{{картинка3D}}}) | |
| Общие | |
| Систематическое наименование | Фосфат (ортофосфат) кальция, фосфорнокислый кальций |
| Хим. формула | Ca3(PO4)2 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 310,18 г/ моль |
| Плотность | 2,81 г/см3(α) 3,067 г/см3(β) |
| Термические свойства | |
| Температура | |
| • плавления | >1200 °C (α) 1670 °C (β) |
| Мол. теплоёмк. | 231,6 Дж/(моль·К) |
| Энтальпия | |
| • | -4112,9 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7758-87-4 |
| PubChem | 24456 |
| Рег. номер EINECS | 231-840-8 |
| SMILES |
|
| InChI |
1S/3Ca.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 QORWJWZARLRLPR-UHFFFAOYSA-H |
| ChEBI | 9679 |
| ChemSpider | 22864 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для(25 °C, 100 кПа), если не указано иное. |
Ортофосфа́т ка́льция (трикальцийфосфат) — неорганическое вещество , соль кальция и ортофосфорной кислоты с химической формулой Ca3(PO4)2. Существует в виде двух модификациях (α и β), отличающихся физическими свойствами. Содержится в костной ткани, входит в состав минералов. Широко применяется в сельском хозяйстве как удобрение, а также для подкормки скота, в промышленности для производства абразивов, керамики и стекла.
Ортофосфат кальция представляет собой бесцветное кристаллическое вещество. Существует в двух модификациях — α ( моноклинная сингония ) и β ( гексагональная сингония ). α-модификация имеет температуру плавления > 1200 °С, плотность 2,81 г/см3; β-модификация — температуру плавления 1670 °C и плотность 3,067 г/см3. Обе модификации имеют плохую растворимость в воде — 0,0025 % (масс.) при 20 °C. При действии кислот ортофосфат кальция переходит в более растворимые гидрофосфаты.
Ортофосфат кальция широко распространён в природе. Входит в состав минералов фосфорита , апатита , гидроксиапатита .
Применяется как источник кальция для подкормки скота и птиц. В составе фосфоритной муки используется как удобрение для кислых почв. Применяют в производстве керамики и стекла, абразивов. Является исходным сырьём для получения фосфорной кислоты и фосфора . Применяется в пищевой промышленности в качестве разрыхлителя. Также входит в состав некоторых лекарств.
- М.: Советская энциклопедия , 1990. — Т. 2: Даффа—Меди. — С. 299. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5 . М.: Мир, 1972. — Т. 2. — 871 с. Л.: Химия, 1971. — Т. 2. — 1168 с.