Диоксид кремния влияние на организм человека. Возможный вред
Диоксид кремния влияние на организм человека. Возможный вред
Большинство людей пугает наличие диоксида кремния в составе продуктов и лекарственных препаратов. На самом деле этот элемент содержится во многих растениях и воде. В человеческом организме он не задерживается, его быстро выводит выделительная система.
Организации по контролю за качеством продуктов питания изучали кремний. Оказалось, что такая добавка безопасна для здоровья. Но ее бездумное применение может причинить вред организму.
Возможны побочные эффекты при передозировке:
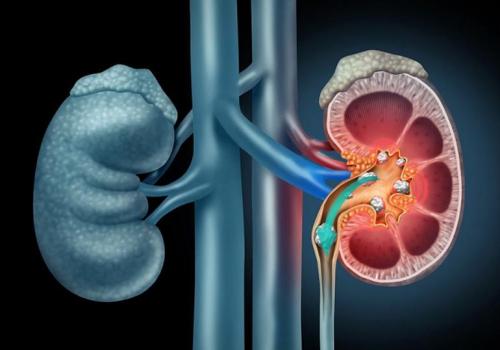
- образование камней в почках;
- появление заболеваний кровеносных сосудов;
- повышение уровня сахара;
- учащение мочеиспускания.
Если долго принимать препараты, содержащие кремний, могут возникнуть проблемы с почками. В них образуются камни, из-за которых человек ощущает боль при мочеиспускании. Мозг человека окружен особым барьером, не позволяющим проникнуть к нему вредным веществам. Под воздействием минерала этот защитный слой может разрушаться. Из-за этого возникают проблемы с кровеносными сосудами — васкулит, образование тромбов. А также могут проявляться заболевания суставов, снижение иммунитета.
Большинство препаратов с диоксидом кремния оказывают мочегонный эффект на организм. Человек страдает не только от обезвоживания, но и от хрупкости костей из-за вымывания кальция. А у диабетиков может резко понижаться уровень сахара в крови.
Кремний усиливает действие других лекарственных препаратов. Перед применением разных средств лучше проконсультироваться с врачом. Но нельзя одновременно принимать кремний с диуретиками или добавками хрома.
SiO2 химические свойства. Химические свойства SiO2

Химические свойства SiO2. Оксид кремния (IV) как и оксид углерода (IV) CO2 является кислотным оксидом. Однако в отличие от CO2 имеет не молекулярную, а атомную кристаллическую решётку. Поэтому SiO2 твёрдое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме плавиковой кислоты HF, но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты – силикатов: SiO2 + 2NaOH = Na2SiO3 + H2O. t0. Силикат натрия.
Слайд 24 из презентации «Соединения кремния» к урокам химии на тему «Кремний»Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать слайд для использования на уроке химии, щёлкните на изображении правой кнопкой мышки и нажмите «Сохранить изображение как…». Скачать всю презентацию «Соединения кремния.ppt» можно в zip-архиве размером 623 КБ.
Кремний
краткое содержание других презентаций о кремнии
«Кремний и его соединения» - Анализ образцов лунного грунта показал наличие SiO2 в количестве более 40%. Химические свойства кремния. Кремний был впервые открыт в 1811 году Гей-Люссаком и Тенаром. Значит, и кирпич - керамика, и кафель, и осколки древнегреческой амфоры - тоже керамика. Изучить свойства кремния. Полупроводник. tплав(Si)=1415 ?C, tплав(алмаз)=3730 ?C.
«Изотопы кремния» - Распределение изотопа кремния-29 по длине затравки. Синтез и глубокая очистка силана. Зонноочищенный кремний. Поликристалл моноизотопного кремния. Защитное покрытие. Теплопроводность изотопнообогащенного кремния-28 в интервале 50-300К. Разделение изотопов кремния. Схема получения моноизотопного кремния.
«Соединения кремния» - Силикаты и водород. Оксид кремния. Разновидности кварца. Природные силикаты. Агат. Аметист. Минералы на основе SiO2. Положение в периодической таблице. Химические свойства SiO2. Кубическая гранецентрированная решётка. Открытие кремния. Топаз. Кремний и его соединения. Химические свойства Si. Силан. Кристаллические решётки.
«Урок Кремний» - Структура слоистая. Графический диктант: алмаз, графит. Характер оксида : а)основной, б) кислотный, в) амфотерный. В водном растворе карбонаты в присутствии углекислого газа превращаются в гидрокарбонаты. Подведение итогов рефлексия. О проявлении неметаллических и металлических свойств. Что можно сказать о размере радиусов атомов от углерода до свинца?
«Углерод и кремний» - Такая смесь называется генераторным газом. Графит. Угольная кислота Получают растворением оксида углерода (IV) в воде. Электронное строение. Алмаз - самое твердое природное вещество. Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин. Клей. Получающийся газ состоит из свободного азота и оксида углерода (II).
Диоксид кремния бад. Так из чего сделан микрогидрин?
Запатентованная минеральная смесь:
1. Калия карбонат - это щелочь.
Ее применяют в мыльной и стекольной промышленности. Зарегистрирован как пищевая добавка E 501
2. Калия цитрат - источник калия.
При передозировке возможные признаки гиперкалиемии: мышечная слабость, парестезии верхних и нижних конечностей, блокада сердца, аритмии.
3. Магния аскорбат - соединение магния и аскорбиновой кислоты.
4. Кальция гироксид - щелочь.
5. Маннитол - осмотический диуретик.
6. Магния сульфат - слабительное.
7. Лимонная кислота.
8. Кремния диоксид (кремнезем), очень мелкий песок. В аптеках он проается под названием "белый уголь". Диоксид кремния - SiO, размер частиц примерно 7-10 нм. Применяется в качестве энтеросорбента.
Этим и объясняются свойства микрогидрина лечить отравления, простуды и аллергии. И он действительно помогает в этих случаях.
Но Диоксид кремния никак не может стоить 2000 рублей, даже если он обогащен сульфатом магния, гидроксидом кальция, маннитолом, цитратом и карбонатом калия и магния аскорбатом.
Описание Микрогидрина в брошюрах Кораллового Клуба.
"Нашему организму нужен суперантиоксидант. Для того, чтобы создать такой продукт, понадобилось более 80-ти лет исследований, шесть Нобелевских лауреатов и несколько номинантов Нобелевской премии, самые последние разработки в области нанотехнологий…"
То, что это чистой воды обман, легко проверить на сайте нобелевского комитета, там ни слова за микрогидрин и Патрика Фланагана.
Продукт создан в 1982 году и коммерчески раскручен как суперпупер сверхмощный антиоксидант.
Антиоксидантные свойства микрогидрина не подтверждены в научных независимых исследованиях.