Как выбрать пробиотики для кишечника. Пробиотики
- Как выбрать пробиотики для кишечника. Пробиотики
- Лучшие пробиотики после антибиотиков. Антибиотик-ассоциированная диарея
- Пробиотики для взрослых. Пробиотики и пребиотики Всемирная Гастроэнтерологическая Организация Практические рекомендации
- Лучшие пробиотики в гинекологии. Взаимосвязь кишечного и влагалищного дисбактериоза
Как выбрать пробиотики для кишечника. Пробиотики
Пробиотики — это живые микроорганизмы и вещества микробного происхождения (микробные метаболиты), оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина путем стабилизации и оптимизации функции его нормальной микрофлоры (2,5-7, 15-17, 19, 20, 28, 29|. В Российской Федерации зарегистрированы препараты-пробиотики. представленные в табл. 4.
Источник: https://semejnayaferma.ru/stati/kak-vybrat-probiotiki-dlya-kishechnika-probiotiki
Лучшие пробиотики после антибиотиков. Антибиотик-ассоциированная диарея
ААД — заболевание, характеризующееся тремя эпизодами жидкого стула или более в течение 2 последовательных дней или более, развившееся в период антибактериальной терапии и вплоть до 4—8 нед после ее отмены .
Терапия антибиотиками провоцирует развитие ААД у 5—50% пациентов. Считается, что возникновение диареи связано с нарушением состава кишечного микробиоценоза и его последствиями, такими как изменение спектра продукции короткоцепочечных жирных кислот (КЦЖК), нарушение микробного метаболизма углеводов и желчных кислот .
Систематический обзор данных 59 РКИ, оценивающих влияние пробиотиков на предотвращение ААД, позволил выделить несколько пробиотических продуктов, эффективность которых при ААД доказана не менее чем в 2 РКИ. Это S. boulardii I-745, пробиотик из смеси 3 штаммов лактобактерий ( L.acidophilus CL1285 + L. casei Lbc80r + L. rhamnosus CLR2) и пробиотик на основе штамма L. casei DN114001 (см. таблицу). Данные пробиотические продукты в дозе 107—1010КОЕ/сут оказывали превентивное действие в случае их приема с 1—2-го дня антибиотикотерапии и далее в течение 1—4 нед после окончания антибиотикотерапии.
Согласно рекомендациям ВГО от 2017 г., применение пробиотиков предотвращает развитие ААД у детей и взрослых, уровень доказательности высокий . Среди бактерий, показавших свою эффективность, ВГО выделяет несколько штаммов Lactobacillus acidophilus (CL1285, NCFM), йогурт, содержащий Lactobacillus casei DN114, L. Bulgaricus и Streptococcus thermophilus , Saccharomyces boulardii CNCM I-745 , Lactobacillus rhamnosus GG , Lactobacillus reuteri DSM 17938 и др. .
Примерно в 1/3 случаев причиной возникновения ААД является инфекция Clostridium difficile , при тяжелом течении которой возможно развитие псевдомембранозного колита, токсической мегаколон. Известно, что C.difficile может обнаруживаться и в кишечнике здоровых лиц, однако на фоне приема антибиотиков и снижения микробного разнообразия толстой кишки данная бактерия приобретает способность синтезировать крайне агрессивные токсины (А и В), вызывающие воспаление кишечной стенки (вследствие нарушения эпителиального барьера, индукции провоспалительных цитокинов, апоптоза и некроза эпителиоцитов).
Проблема целесообразности применения пробиотиков в предотвращении Clostridium difficile -ассоциированной болезни изучена в 23 РКИ , по результатам некоторых из них сделан вывод об эффективности S. boulardii CNCM I-745, L. casei DN114001, L. rhamnosus GG и пробиотика, состоящего из смеси 3 штаммов Lactobacillus acidophilus CL1285 , L. casei LBC80R и L. rhamnosus CLR2 (см. таблицу). В то же время более чем в 50% исследований не обнаружена польза от приема пробиотиков, содержащих вышеперечисленные штаммы .
Пробиотики часто используются не только для профилактики, но и в схемах лечения инфекции Clostridium difficile , как дополнение к антибиотикотерапии (ванкомицин и метронидазол) с целью предотвращения рецидивов заболевания . На сегодняшний день доступны данные двух РКИ (см. таблицу), показывающих, что применение S. boulardii I-745 снижает вероятность развития рецидива инфекции. В то же время в двух других исследованиях, включавших в качестве пробиотика штамм L. rhamnosus GG, не получены доказательства влияния данного штамма на снижение частоты рецидивов инфекции Clostridium difficile .
Согласно рекомендациям ВГО, целесообразность применения пробиотиков для профилактики инфекции Clostridium difficile и ее рецидивов нуждается в дальнейшем изучении, поскольку уровень доказательности большинства из них не внушает доверия .
Известно, что эрадикационная терапия, проводимая комбинацией 2—3 антибиотиков совместно с ингибиторами протонной помпы, зачастую сопровождается развитием широкого спектра побочных эффектов и нежелательных явлений (диарея, тошнота, рвота, боль в животе), связанных в том числе с влиянием на микробный состав желудочно-кишечного тракта. Как показали данные РКИ (см. таблицу), S. boulardii I- 745, L. rhamnosus GG, а также комбинация 2 штаммов лактобактерий L. helveticus R52 + L. rhamnosus R11, применяемые во время эрадикации, могут улучшать переносимость терапии, снижая выраженность побочных эффектов .
Кроме того, согласно данным метаанализа, выполненного L. McFarland и соавт., добавление пробиотика, содержащего S. boulardii CNCM I-745, в схемы эрадикационной терапии, повышает эффективность эрадикации (ОР=1,11, 95% ДИ 1,07—1,16; p .
Таким образом, с позиций доказательной медицины назначение пробиотиков на период эрадикационной терапии представляется целесообразным как с точки зрения достижения успешной эрадикации, так и для предотвращения побочных эффектов и лучшей переносимости терапии.
В Российской Федерации упомянутая выше комбинация 2 штаммов бифидо и лактобактерий ( L. acidophilus La5 + Bifido. lactis Bb12), доказавшая способность повышать уровень успешной эрадикации по меньшей мере в 3 РКИ, представлена в составе препаратов Пробиолог и Пробиолог форте («Майоли Спиндлер», Франция), содержащих не менее 1·109и 2,5·109КОЕ в 1 капсуле соответственно.
LA-5 ( Lactobacillus acidophilus ) и ВВ-12®( Bifidobacterium ) являются одними из наиболее изученных штаммов лакто- и бифидобактерий в мире, используются в пищевой и медицинской промышленности с 1979 и 1985 г. соответственно, что позволяет не сомневаться в их безопасности, подтвержденной статусами GRAS (FDA, США) и QPS (Европейское агентство по безопасности продуктов питания).
Пробиолог отличается оригинальной технологией производства, позволяющей максимально сохранить жизнеспособность и функциональную активность штаммов.
Штаммы живых бактерий LA-5 и ВВ-12 заключены в кислотоустойчивую полисахаридную оболочку, которая при попадании в жидкость превращается в нерастворимый гель, устойчивый к действию кислоты. Благодаря этому, доля выживаемости бифидо- и лактобактерий (согласно исследованию in vitro ) составляет 73%. Пробиолог рекомендуется взрослым и детям старше 7 лет по 1—2 капсулы в день во время еды, запивать водой. Продолжительность приема составляет 10—30 дней.
Согласно данным систематического обзора J. Sniffen и соавт., в профилактике диареи путешественников, которая, по самым приблизительным оценкам, поражает 24—40 млн человек в год, оказались эффективными штаммы S. boulardii I-745. Начинать прием пробиотиков необходимо за несколько дней до путешествия, продолжая его во время поездки и в течение 5 дней после возвращения. Рекомендованная доза 2—5·10КОЕ/сут.
Пробиотики для взрослых. Пробиотики и пребиотики Всемирная Гастроэнтерологическая Организация Практические рекомендации
| Авторы |
Приглашенные эксперты Pedro Kaufmann (Уругвай)Juan Andres de Paula (Аргентина)Richard Fedorak (Канада)Fergus Shanahan (Ирландия)Mary Ellen Sanders (США)Hania Szajewska (Польша)
1. Пробиотики – концепция
1.1 История и определения1.2 Что такое пробиотики?1.3 Пребиотики и синбиотики1.4 Класс, виды и штаммы
2. Продукты, медицинская значимость и продажа
2.1 Рыночный потенциал2.2 Медицинская значимость2.3 Обоснованность – исследования и доказательства2.4 Продукты: дозы и качество2.5 Безопасность продукта
3. Пробиотики – научные данные
3.1 Микробная экосистема и иммунитет слизистой оболочки3.2 Механизмы действия
4. Клиническое применение
4.1 Кардиоваскулярные заболевания4.2 Рак толстой кишки4.3 Диарея4.4 Эрадикация Helicobacter pylori4.5 Печеночная энцефалопатия4.6 Иммунный ответ4.7 Воспалительная болезнь кишечника (ВБК)4.8 Синдром раздраженного кишечника (СРК)4.9 Мальабсорбция лактозы4.10 Некротический энтероколит4.11 Неалкогольная жировая болезнь печени4.12 Профилактика системных инфекций
5. Пробиотики и доказательства – глобальная картина
6. Поиск, рекомендуемая литература и сайты в Интернете
6.1 Автоматический поиск в PubMed6.2 Рекомендуемая литература6.3 Сайты в Интернете
1. Пробиотики – концепция
1.1 История и определения
Сто лет назад, Илья Мечников (русский ученый, лауреат Нобелевской премии и профессор Пастеровского института в Париже) выдвинул теорию, что бактерии молочной кислоты (БМК) способствуют улучшению здоровья и долголетию. Он предположил, что «кишечная аутоинтоксикация» и возникающие вследствие ее вещества могут быть продавлены с помощью модификации кишечных бактерий и замены протеолитических микробов, таких как, производящих токсические вещества (включая фенолы, индолы и аммиак после переваривания белков), на полезные микроорганизмы. Он разработал диету с добавлением молока, ферментированного бактерией, которую он назвал «Болгарской палочкой».
В 1917 году, еще до открытия сэром Александром Флемингом пенициллина, германский профессор Альфред Ниссле изолировал непатогенный штаммиз фекалий солдата Первой мировой войны, который не вызывал развития энтероколита во время тяжелой эпидемии шигеллеза. Заболевания желудочно – кишечного тракта и ранее часто лечились жизнеспособными непатогенными бактериями для изменения или замещения кишечных микроорганизмов. Штамм кишечной палочки Ниссле 1917 – один из немногих примеров не-БМК пробиотиков.
Бифидобактерия была впервые изолирована Анри Тиссье (Пастеровский институт) от новорожденного, получавшего грудное кормление, и названа им Bacillus bifidus communis. Тиссье утверждал, что бифидобактерии могут заменить протеолитические бактерии, вызывающие диарею, и рекомендовал введение бифидобактерий новорожденным, страдающим от этого синдрома.
Термин «» впервые был введен в 1965 г. Лилли и Стиллуэллом; в противоположность антибиотикам, пробиотики были описаны как микробные факторы, стимулирующие рост других микроорганизмов. В 1989 г. Рой Фуллер подчеркнул необходимость жизнеспособности пробиотиков и выдвинул идею о их положительных действиях для пациентов.
Определение 1:
Пробиотики
- Живые микроорганизмы, которые при введении в адекватном количестве, оказывают положительный эффект на здоровье хозяина
- Невсасывающиеся вещества, которые оказывают положительный физиологический эффект на хозяина, селективно стимулируя необходимый рост или активность кишечной микрофлоры
- Продукты, содержащие пробиотики и пребиотики
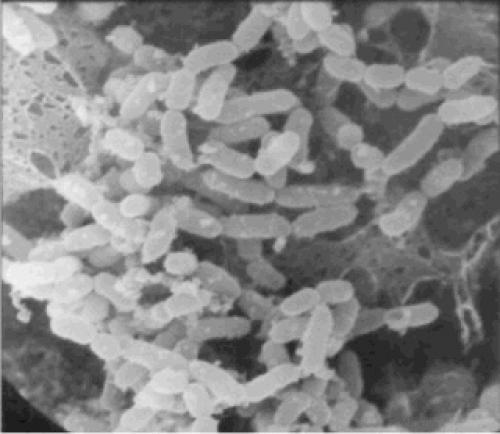
Рис. 1 Электронная микрография Lactobacillus salivarius 118, адгезированной к Caco-2 клеткам (источник: Neurogastroenterol Motil 2007;19:166–72)
1.2 Что такое пробиотики?
Пробиотики – это живые микроорганизмы, которые могут быть включены в состав различных типов пищевых продуктов, а также лекарственные препараты и пищевые добавки. Наиболее часто используются в качестве пробиотиков штаммы(рис. 1) и. Также для этой роли могут подходить дрожжевые грибки рода сахаромицетов —и некоторые штаммы. БМК, включая штаммы лактобактерий, которые использовались в течение тысячелетий для ферментации пищи, обладают двойным действием как ферментативные агенты и, дополнительно, потенциальным оздоравливающим эффектом. Тем не менее, строго говоря, термин «пробиотики» должен употребляться в отношении живых микроорганизмов, показавших в контролируемых исследования пользу для здоровья человека. Ферментация пищевых продуктов дает им характерный вкус и снижает их, что предотвращает заражение потенциальными патогенами. Ферментация в основном применяется в сохранении широкого спектра сельскохозяйственных продуктов (зерновые культуры, корнеплоды, клубни, фрукты и овощи, молоко, мясо, рыба и т.д.).
Лучшие пробиотики в гинекологии. Взаимосвязь кишечного и влагалищного дисбактериоза
Большинство предрасполагающих факторов одинаковы как для влагалищного, так и для кишечного микробиоценоза. Взаимосвязь между дисбиозом кишечника у женщин и репродуктивным здоровье можно отследить на примере такого заболевания, как эндометриоз. Это патологическое состояние характеризуется формированием очагов эндометрия за пределами полости матки.
Немалое значение в механизме развития данного гинекологического заболевания, играют ретроградные менструации, при которых жизнеспособные клетки слизистой оболочки матки попадают в брюшную полость. Вероятность развития эндометриоза при таком сценарии во многом зависит от реакции иммунной системы, важным звеном которой является микробиота кишечника.
Кроме того, дисбаланс микрофлоры в кишечнике и влагалище, может приводить к увеличению уровня эстрогенов в организме женщины, что способствует быстрому прогрессированию эндометриоза. Повышение уровня гормонов эстрогенов, также способствует стремительному росту как доброкачественных, так и злокачественных новообразований женской репродуктивной системы.
Сам по себе дисбактериоз влагалища является тем состоянием, которое в буквальном смысле нарушает естественную защиту женской репродуктивной системы. Снижение местного иммунитета и активизация болезнетворных микроорганизмов увеличивает до максимума риск развития инфекционно-воспалительных заболеваний органов малого таза, чреватых развитием осложнений, включая бесплодие.
Также, была клинически подтверждена связь между нарушением баланса влагалищной микрофлоры и высоким риском формирования рака и предрака шейки матки. Сравнительное исследование мазков из шейки матки здоровых женщин и пациенток с диагностированным предраком шейки матки доказало разность состава микрофлоры. В первом случае, в мазке преобладают лактобактерии, а во втором случае, над полезной микрофлорой доминируют условно патогенные и патогенные микроорганизмы. Кроме того, дефицит лактобацилл в просвете влагалища, подрывает сопротивляемость женского организма перед вирусом папилломы человека (ВПЧ), который в 90% случаев является причиной развития онкологии шейки матки.