Фосфат натрия, что это. Натрий фосфорнокислый 2-замещенный — популярная пищевая добавка
Фосфат натрия, что это. Натрий фосфорнокислый 2-замещенный — популярная пищевая добавка
- В пищепроме это добавка E339ii — эмульгатор, регулятор кислотности, стабилизатор окраски и консистенции, усилитель действия антиоксидантов, соль-модификатор. Служит солью-эмульгатором при изготовлении плавленых сыров всех типов. Не позволяет молоку при длительном хранении превращаться в желе, загустевать. E339ii добавляют в сырое молоко, чтобы защитить белки и жиры от разрушения при термообработке. При производстве сгущенного молока реагент не дает готовому продукту кристаллизоваться.
- Используется при производстве макаронных изделий, благодаря чему они готовятся быстрее. Применяется при изготовлении колбас.
- В кондитерском деле — регулятор кислотности при производстве зефира, желе, желейных конфет, мармелада. В качестве соли-модификатора его добавляют во фруктовые или ягодные смеси, содержащие пектин, для изготовления желейных конфет и мармелада. Такие пюреобразные смеси можно готовить в больших объемах и перекачивать на большие расстояния. Используется при производстве халвы, карамели как консервант, блокирующий преобразование сахара во фруктозу и глюкозу.
- В фармацевтике — наполнитель таблеток
 (омепрозол, трихопол, омеза, азимед); антацид; слабительное; средство для очистки кишечника перед инструментальными манипуляциями, операциями.
(омепрозол, трихопол, омеза, азимед); антацид; слабительное; средство для очистки кишечника перед инструментальными манипуляциями, операциями. - В медицине применяется для внутривенных вливаний для регулирования кислотно-щелочного баланса крови.
- В биологии входит в состав буферного изотонического раствора для исследований; питательная среда Эндо для выделения энтеробактерий.
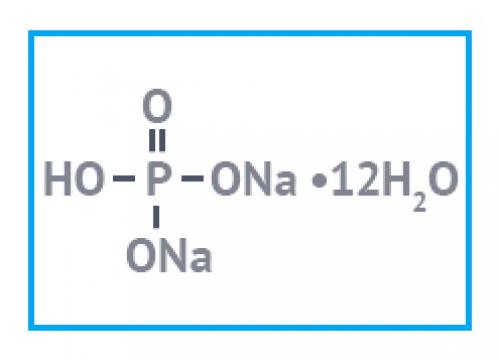
Натрий фосфорнокислый 2-замещенный — неорганическоесоединение, кислая соль натрия и фосфорной кислоты. В литературе может также называться гидрофосфатом или гидроортофосфатом натрия, динатрий фосфатом (ДНФ), натрий фосфатом 2-замещенным, пищевой добавкой E339ii. Формула — Na2HPO4.
Получают реактив взаимодействием раствора гидроокиси натрия NaOH с раствором фосфорной кислоты H3PO4 или с дигидрофосфатом натрия NaH2PO4.
Свойства
Сыпучее вещество, состоящее из бесцветных прозрачных кристалликов или гранул. Водорастворимо, гигроскопично. Образует кристаллогидраты с 2-мя, 7-ю и 12-ю молекулами воды. Плохо растворяется в этиловом спирте. При нагревании кристаллогидрата он сначала теряет воду, а потом разлагается до пирофосфата Na4P2O4. При хранении на открытом сухом воздухе кристаллогидраты постепенно теряют влагу, выветриваются.
Раствор имеет слегка щелочную реакцию. Вступает в реакции со щелочами c образованием солей фосфорной кислоты. В результате взаимодействия с фосфорной кислотой получается дигидрофосфат NaH2PO4. Обменные реакции с солями сильных кислот приводят к образованию новых солей.
 | |
| Перчатки "Бай Колор" (Ansell) р. 8,5-9 | Натрий фосфорнокислый 2-замещенный, 12 водный ХЧ |
Меры предосторожности
Попадание раствора, пыли или аэрозоля вещества на кожу, слизистые глаз или органов дыхания вызывает раздражение.
Большая передозировка медицинских препаратов, содержащих гидрофосфат натрия, может оказать резко негативное влияние на почки, сердце и даже привести к смерти. Особенно осторожно нужно использовать такие средства для детей младше 5 лет, пожилым людям, пациентам с заболеваниями кишечника, почек.
Внимание! Не пользуйтесь препаратами, содержащими динатрий фосфат, без консультации с врачом, даже если это безрецептурный препарат.
Работать с реактивом следует в помещении, снабженным принудительной общей вентиляцией. Сотрудник должны использовать средства защиты: спец. одежду с длинными рукавами, резиновые перчатки, маску или респиратор и защитные очки.
Хранят гидрофосфат натрия в герметичной таре, защищая от влаги воздуха, на крытых отапливаемых складах. Перевозят любым видом транспорта.
Применение
Производство гидрофосфата натрия относится к многотоннажному.
Фосфат кальция. Ортофосфат кальция
| Ортофосфат кальция | |
|---|---|
| ( {{{картинка}}})  ( ({{{картинка3D}}}) | |
| Общие | |
| Систематическое наименование | Фосфат (ортофосфат) кальция, фосфорнокислый кальций |
| Хим. формула | Ca3(PO4)2 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 310,18 г/ моль |
| Плотность | 2,81 г/см3(α) 3,067 г/см3(β) |
| Термические свойства | |
| Температура | |
| • плавления | >1200 °C (α) 1670 °C (β) |
| Мол. теплоёмк. | 231,6 Дж/(моль·К) |
| Энтальпия | |
| • | -4112,9 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7758-87-4 |
| PubChem | 24456 |
| Рег. номер EINECS | 231-840-8 |
| SMILES |
|
| InChI |
1S/3Ca.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 QORWJWZARLRLPR-UHFFFAOYSA-H |
| ChEBI | 9679 |
| ChemSpider | 22864 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для(25 °C, 100 кПа), если не указано иное. |
Ортофосфа́т ка́льция (трикальцийфосфат) — неорганическое вещество , соль кальция и ортофосфорной кислоты с химической формулой Ca3(PO4)2. Существует в виде двух модификациях (α и β), отличающихся физическими свойствами. Содержится в костной ткани, входит в состав минералов. Широко применяется в сельском хозяйстве как удобрение, а также для подкормки скота, в промышленности для производства абразивов, керамики и стекла.
Ортофосфат кальция представляет собой бесцветное кристаллическое вещество. Существует в двух модификациях — α ( моноклинная сингония ) и β ( гексагональная сингония ). α-модификация имеет температуру плавления > 1200 °С, плотность 2,81 г/см3; β-модификация — температуру плавления 1670 °C и плотность 3,067 г/см3. Обе модификации имееют плохую растворимость в воде — 0,0025 % (масс.) при 20 °C. При действии кислот ортофосфат кальция переходит в более растворимые гидрофосфаты.
Ортофосфат кальция широко распространён в природе. Входит в состав минералов фосфорита , апатита , гидроксиапатита .
Применяется как источник кальция для подкормки скота и птиц. В составе фосфоритной муки используется как удобрение для кислых почв. Применяют в производстве керамики и стекла, абразивов. Является исходным сырьём для получения фосфорной кислоты и фосфора . Применяется в пищевой промышленности в качестве разрыхлителя. Также входит в состав некоторых лекарств.
- М.: Советская энциклопедия , 1990. — Т. 2: Даффа—Меди. — С. 299. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5 . М.: Мир, 1972. — Т. 2. — 871 с. Л.: Химия, 1971. — Т. 2. — 1168 с.
Натрия фосфат. Фосфаты натрия
| Название: | Фосфаты натрия |
| Тип: | Пищевая добавка |
| Категория: | Антиоксиданты |
| Описание группы: | Антиоксиданты — добавки с индексом (E-300 - E-399) защищают продукты питания от окисления, прогорькания и изменения цвета. Представляют собой как природные соединения(аскорбиновая кислота, витамин Е), так и химически синтезированные, не встречающиеся в природе соединения. Добавляют в жировые и масляные эмульсии (напримет, майонез). |
- Разрешающие применение — 4
- Упоминаний о добавке— 5
Законы и документы о пищевой добавке:
- Россия — разрешена
- Украина — разрешена
- Беларусь — разрешена
- Евросоюз — разрешена
- США — нет данных
- Канада — нет данных
Применение добавки по странам:
Просмотреть документы
Описание пищевой добавки
Описание пищевой добавки
Пищевая добавка Е-339 – это смесь натриевых солей ортофосфорной кислоты в различных формах. В нее входят: ортофосфат натрия однозамещенный , двухзамещенный, трехзамещенный и триполифосфат натрия .
Применение
Данная добавка активно используется во многих сферах жизни человека, в том числе в пищевой отрасли. Там антиоксидант играет роль регулятора кислотности, эмульгатора, стабилизатора и фиксатора красящих веществ. Это обусловлено многочисленными свойствами пищевого антиоксиданта Е-339 Ортофосфат натрия, в частности его способностью предохранять продукты от пригорания, сохранять их цвет при термической обработке, а также наделять их мягкой, нежной структурой. Кроме того, замечено, что ортофосфаты натрия могут использоваться в качестве влагоудерживающего агента и усилителя свойств антиоксидантов. В небольшом количестве Е-339 можно найти в составе следующих продуктов питания: кондитерские и хлебобулочные изделия (в качестве разрыхрытеля), молочные продукты, включая сухие сливки и молоко, супы , пюре быстрого приготовления, концентрированные бульоны, соусы, запрвки, кетчупы, пасты и чаи (растворимые, гранулируемые). Ортофосфаты натрия содержатся в составе мясных и рыбных изделий (консервы, колбасы, копчености), сыров и продуктов быстрого приготовления. При производстве плавленых сыров пищевая добавка Е-339 используется в качестве соли-плавителя. Ортофосфат натрия Е-339 нашел применение в химической промышленности, его добавляют в чистящие и моющие средства, стиральные порошки, отбеливатели. В странах Европы отказались от использования моющих средств, содержащих фосфаты натрия . Они попадают в водоемы и приводят к их эвтрофикации, что в свою очередь опасно для экосистемы. В медицинской промышленности соли используют в качестве слабительного препарата.
Влияние на организм человека
Пищевая добавка Е-339 считается безвредной для организма человека. Но при употреблении E-339 в больших количествах наблюдаются расстройства желудочно-кишечного тракта, так как антиоксидант обладает слабительным эффектом. Поэтому не стоит увлекаться продуктами питания с содержанием фосфатов натрия. Кроме того, вред пищевого антиоксиданта Е-339 Ортофосфат натрия выражается в вымывании кальция из зубной и костной ткани, что также неблагоприятно отражается на состоянии здоровья в общем. Пищевой антиоксидант входит в список разрешенных добавок для применения в пищевой промышленности стран Европейского союза, Украины и Российской Федерации.
Физико-химические свойства фосфатов натрия
Фосфаты натрия получают химическим путем при взаимодействии фосфорной кислоты с гидроксидом натрия. Внешне пищевая добавка Е-339 представляет собой гранулированный или кристаллический порошок, окрашенный в белый цвет. Антиоксидант устойчив к воздействию высоких температур, он отлично растворяется в воде.
Фосфаты натрия Е-339 получают путем взаимодействия ортофосфорной кислоты с гидроксидом натрия или кальцинированной содой.
Фосфат натрия + хлорид кальция. Как получить фосфат кальция
Фосфат кальция (другие названия – ортофосфат кальция, трикальцийфосфат) – неорганическая соль, имеющая формулу Са3(РО4)2. Ее внешний вид – бесцветные кристаллы, часто имеющие разные цветовые оттенки, от светло-серого до кремово-розового, практически нерастворимые в воде. Это вещество играет важнейшую роль в жизни людей, а также всех позвоночных существ, поскольку именно из него главным образом состоят их кости и зубы. Фосфат кальция широко применяется в разных областях промышленности и сельского хозяйства.

Вам понадобится
- - любая реакционная емкость - раствор фосфата натрия;
- - раствор хлорида кальция;
- - раствор фосфата натрия;
- - стеклянная воронка с бумажным фильтром;
- - емкость для слива растворимых продуктов реакции.
Инструкция
1
Для начала вам необходимо приготовить навески следующих солей : фосфат натрия , хлорид кальция . Их количества можно рассчитать по следующей формуле реакции: 2Na3PO4 + 3CaCl2 = Ca3(PO4)2 + 6NaCl. При этом учитывайте молярные массы каждого элемента и коэффициенты. Запомните, что молярная масса двух молекул фосфата натрия (328) очень близка к молярной массе трех молекул хлорида кальция (333), именно поэтому для упрощения расчетов можно признать их одинаковыми и взять, соответственно, одинаковые количества исходных веществ. Например, по одному грамму.
2
После этого высыпьте вышеперечисленные соли в пробирки или же в небольшие лабораторные стаканы. Понемногу добавляйте воды и перемешивайте, делайте это до полного растворения компонентов. Можно одну из солей (безразлично какую именно) растворить непосредственно в реакционной емкости, например, в небольшой плоскодонной колбе с широким горлом. Если же нет емкости под рукой, можно использовать и обычный лабораторный стакан.
3
Затем смешайте растворы солей в реакционной емкости. Тотчас же должна образоваться белая «взвесь», которая с большой скоростью будет выпадать в осадок.
4
Затем отделите осадок фосфата кальция от раствора хлорида натрия с помощью фильтрования. Для этого вам необходима стеклянная воронка с бумажным фильтром, потихоньку вливайте в нее образовавшийся раствор.
5
Далее можно просто высушить полученный продукт на воздухе или в любом проветриваемом помещении в течение нескольких часов. Помните, что он довольно быстро обезвоживается, при этом принимая кристаллический вид.
Обратите внимание
При получении того или иного вещества из растворимых компонентов, всегда используйте емкость для слива, это поможет вам аккуратно провести реакцию.
Полезный совет
Реакция идет до конца, так как один из продуктов удаляется из реакционной зоны, то есть выпадает в осадок.
Источник: https://zdorovecheloveka.com/stati/fosfat-natriya-chto-eto-trifosfat-natriya
 (омепрозол, трихопол, омеза, азимед); антацид; слабительное; средство для очистки кишечника перед инструментальными манипуляциями, операциями.
(омепрозол, трихопол, омеза, азимед); антацид; слабительное; средство для очистки кишечника перед инструментальными манипуляциями, операциями.